
STERIGENE fournisseur majeur dans le domaine de l’ultrapropreté et expert en gestion de projets a intégré le groupe SYNEXIN depuis début 2022. De par la fusion des connaissances des process et des expériences dans la gestion de projet pour l’industrie pharmaceutique de ses entités, SYNEXIN est à même de vous accompagner dans la réalisation de votre projet.
SYNEXIN regroupe plusieurs entités compétentes dans les procédés propres et stériles, dans l’expertise aéraulique, dans la conception et l’agencement de zones critiques ainsi que dans le consommable pour salle propre. Il ne s’agit pas seulement de proposer pour votre projet les équipements, le mobilier ou les consommables dont vous avez besoin mais de vous accompagner lors de sa réalisation avec une gestion globale : de la mise en place à la finalisation en passant par la qualification de vos équipements ou de vos environnements critiques via un suivi technique dédié.
SYNEXIN est une société qui regroupe plusieurs entités, toutes spécialisées dans différents métiers liés aux environnements critiques.
Besoin d’un renseignement ?
Découvrir l’ensemble de SYNEXIN en 5min

L’interlocuteur unique pour l’ingénierie de vos procédés propres et stériles : équipements process, prestations techniques, consommables et équipements du personnel.

Le spécialiste dans le domaine des environnements contrôlés : équipements et composants pour systèmes aérauliques, qualification des environnements critiques.

L’expert dans l’intégration et la fabrication de mobilier sur-mesure pour salles propres : tables de mirage, bancs de passage, meubles, distributeurs de consommables et vestiaires.
Fort de ce savoir et de ses compétences, SYNEXIN est à même de proposer et d’établir une stratégie de validation de votre projet basée sur les analyses de risques process ainsi que les qualifications de conception de vos projets.
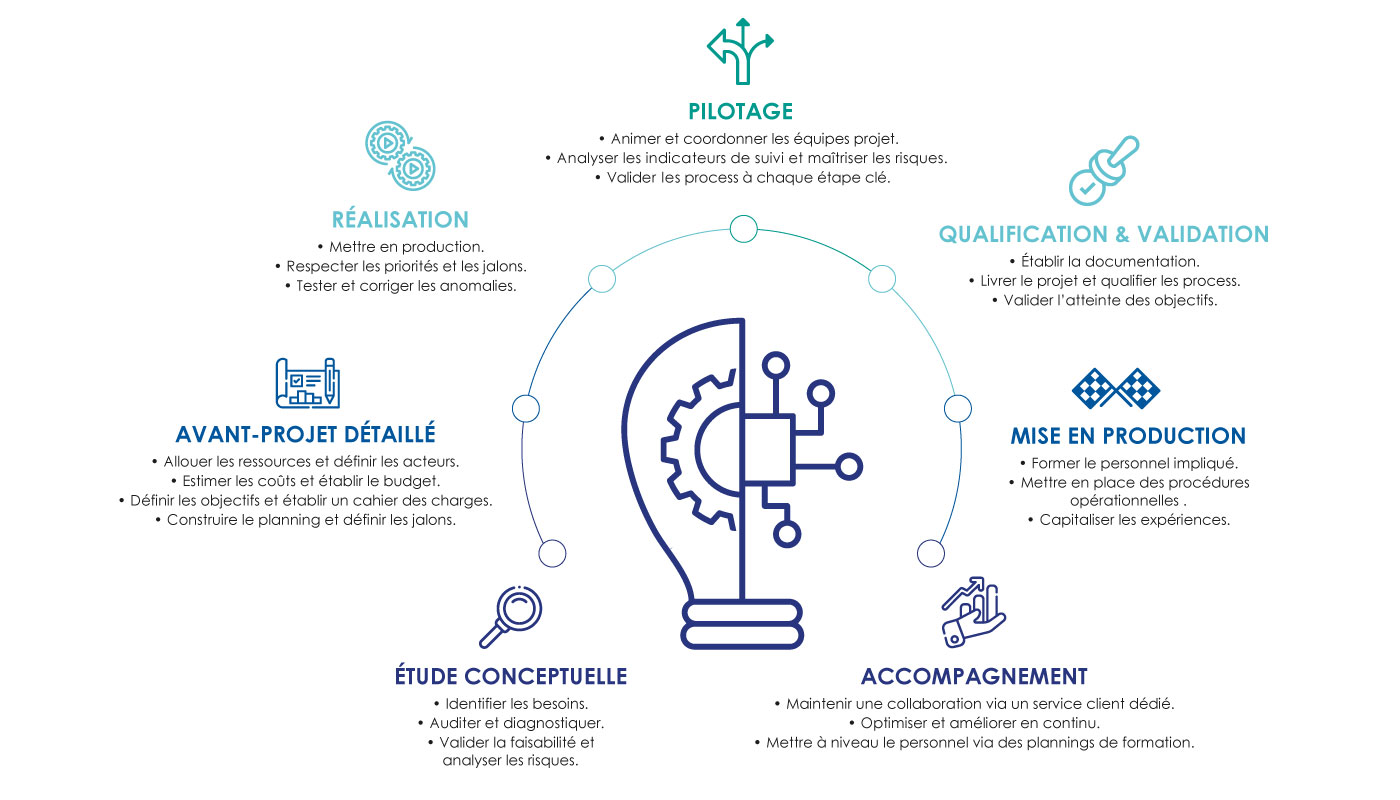
NOTRE MÉTHODE
PLAN DIRECTEUR DE VALIDATION
Le plan directeur de validation identifie les stratégies et les outils utilisables pour réaliser et contrôler les activités de commissioning et qualifications nécessaires permettant d’assurer le transfert de l’intégralité des installations aux exploitants.
D’après l’annexe 15 des BPF, le plan directeur de validation ou document équivalent doit définir le système de qualification / validation et inclure ou référencer au minimum des informations sur les éléments suivants :
- La politique de qualification et de validation ;
- Les normes et règlementions de référence ;
- La structure organisationnelle incluant les rôles et responsabilités pour les activités de qualification et de validation ;
- Le récapitulatif des installations, des équipements, des systèmes et des procédés du site et leur statut de qualification et de validation ;
- La maîtrise des changements et la gestion des déviations appliquées à la qualification et la validation ;
- Les recommandations pour la détermination des critères d’acceptation ;
- Les références aux documents existants ;
- La stratégie de qualification et de validation, incluant la re-qualification, le cas échéant.
Il permet également de :
- Spécifier les limites ou périmètres d’action entre le client et fournisseur
- Spécifier un planning macro de la stratégie de validation
- Contrôler le transfert des installations (transfert des fournisseurs au client et transfert du projet aux exploitants)
ANALYSE DE RISQUES
L’analyse des risques procédés est une étape essentielle dans la gestion d’un projet. Il s’agit de :
- Réaliser l’inventaire des risques pour tous les intervenants (maintenance, opérateurs, métrologie)
- Valoriser les risques avec une cotation des risques selon la gravité calculée à partir de l’occurrence, la fréquence et la détectabilité
- Définir des parades et tests adaptés selon la cotation des risques afin de réduire leur occurrence.
Toutes ces étapes ayant pour but d’identifier les éléments critiques qui seront nécessairement intégrés dans les qualifications. Nous vous proposons ainsi un dossier comprenant :
- Un récapitulatif de chaque fonction de votre système
- Un récapitulatif des risques associés à chaque fonction
- L’identification des causes et conséquences de chaque risque ainsi que leur criticité
- Les moyens de maîtrise possibles de ses risques
- L’élaboration de la stratégie de validation via la définition des tests de validation
Ce dossier est établi selon les référentiels règlementaires ci-dessous.
| RÉFÉRENCE | INTITULÉ / SOURCE |
| BPF révisée le 26/11/2020 | Bonnes Pratiques de Fabrication |
| EU GMP – Annexe 1 22/08/2022 | Fabrication des médicaments stériles |
| BPF – Annexe 11 | Systèmes informatisés |
| BPF – Annexe 15 | Qualification et Validation |
| ISO 9001 rev 2015 | Norme des systèmes de Management de la Qualité |
| ICH Q9 | ICH Harmonised Tripartite Guideline « Quality Risk management » |
| ISPE Baseline guide Vol5 | ISPE baseline Pharmaceutical Engineering Guide for New and Renovated Facilities, Vol5 « Commissioning and Qualification » |
| ISPE Baseline Guide Vol12 (Gamp 5) | Science and Risk Based Approach for the Delivery of Facilities, Systems and Equipment |
QUALIFICATION DE CONCEPTION
La qualification de conception est le document dans lequel la conformité de la conception avec les référentiels requis doit être démontrée et documentée. Les exigences formulées dans les cahiers des charges de l’utilisateur doivent également être vérifiées pendant la qualification de la conception.
Nous vous proposons un document reprenant point par point les exigences de vos cahiers des charges ainsi que celles des BPF relatives à votre système, dans lequel chaque conformité est notifiée puis justifiée par l’indication du document fournisseur.
Ce document permet donc de mettre en évidence les points d’attention, de risque, ou de déviations en amont de la réalisation et de déclencher les actions correctives adéquates.


