L’industrie pharmaceutique est soumise à des normes de qualité et de sécurité strictes pour garantir l’intégrité et l’efficacité des produits qui arrivent sur le marché. La réglementation encadre les environnements et processus de fabrication pour éviter les risques de contamination.
Les récentes évolutions de l’Annexe 1 des GMP EU renforcent encore les directives relatives au contrôle des contaminations dans les environnements de production.
Initialement, le texte donnait aux industriels jusqu’à août 2023 pour se mettre en conformité avec les nouvelles exigences. Même si les premiers contrôles ne devraient pas intervenir avant 2024, il est important pour les acteurs concernés de se tenir prêts.
Dans ce contexte, le bionettoyage joue un rôle crucial pour assurer un environnement de production afin de limiter les risques de contamination.
Dans cet article, découvrez en quoi consiste le bionettoyage et comment il s’inscrit dans la stratégie de contrôle de la contamination et répond aux enjeux de propreté des salles.
Besoin d’un renseignement ?
Quelles sont les caractéristiques d’une salle propre ?
Qu’est ce qu’une salle propre ?
Une salle propre est un environnement contrôlé et spécialement conçu pour maintenir un niveau élevé de propreté et de contrôle de la contamination.
Les salles propres et les environnements maîtrisés apparentés fournissent des moyens pour maîtriser la contamination de l’air et, le cas échéant, des surfaces à des niveaux appropriés pour les activités sensibles à la contamination telles que l’industrie aérospatiale, la micro-électronique, l’industrie pharmaceutique, les dispositifs médicaux, la santé, l’industrie alimentaire, …
La qualification des salles propres
La norme ISO 14644 établit les lignes directrices pour la classification et la surveillance des salles propres.
Elle divise les salles propres en classes en fonction de la concentration en nombre de particules par volume d’air. Chaque classe de salle propre a des plafonds spécifiques de concentrations de particules par volume.
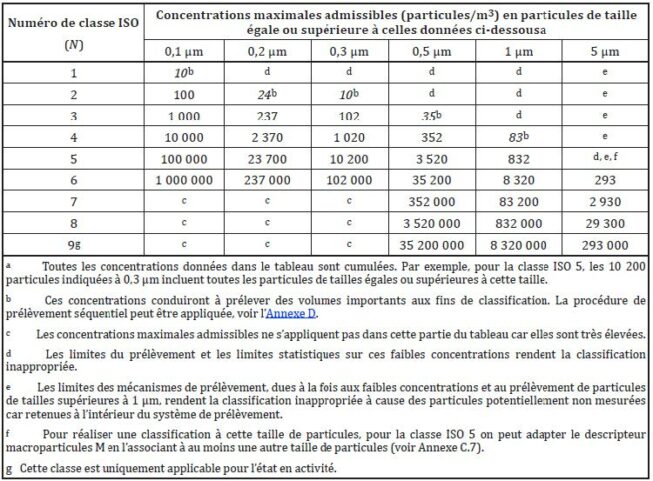
La qualification des salles propres en pharmaceutique
Les salles propres sont utilisées principalement dans la fabrication de produits pharmaceutiques sensibles, tels que les médicaments stériles, les dispositifs médicaux et d’autres produits sensibles aux contaminants microbiens et particulaires.
Dans ce contexte, la qualification des salles propres dépend des concentrations particulaires et microbiennes définies dans les GMP. Pour les productions de médicaments stériles, les limites sont définies dans l’annexe 1 des GMP EU, mise à jour en août 2022.
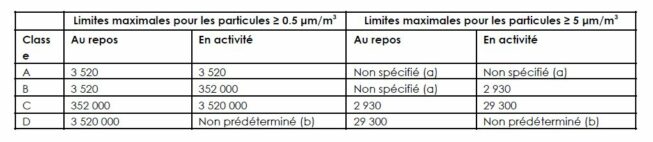
Une fois la salle propre qualifiée, l’industriel doit mettre en œuvre un monitoring pour maintenir le niveau de propreté adéquat.
Le bionettoyage, l’étape ultime vers un environnement propre
Quelles étapes pour maintenir les requis de propreté ?
Traditionnellement, on distingue 3 types de contamination :
- La contamination particulaire : particules inertes, poussières, fibres, déchets…
- La contamination microbiologique ou biocontamination : microorganismes et particules viables
- La contamination chimique ou moléculaire : contaminants chimiques, résidus
Selon le type d’industrie concerné, l’attention portera plus particulièrement sur un ou plusieurs types de contaminations. En industrie pharmaceutique (ou cosmétique), les exigences de propreté sont telles qu’elles concernent à la fois les contaminations microbiologiques, chimiques et particulaires.
Pour maintenir les requis de propreté, les contaminants et leurs vecteurs de contamination doivent être éliminés ou minimisés. Pour cela plusieurs éléments doivent être pris en compte :
- La conception de la salle : CTA qualifiée, salle en surpression
- L’isolation de la production : technologies barrières, séparation des flux matières et hommes…
- La limitation des contaminants entrants : habillage, tapis d’entrée produits à faible relargage, suremballage des consommables…
- L’élimination des contaminants : procédé global d’élimination ou de réduction de tout contaminant d’une zone, d’un objet ou d’une personne
En quoi consiste le bionettoyage ?
La dernière étape, est appelée la désinfection, et elle consiste à utiliser des produits biocides pour détruire, ou rendre inoffensifs les organismes nuisibles, par une action chimique ou biologique. Les produits de désinfection peuvent être :
- Pulvérisés sur un tissu adapté
- Imprégnés sur place dans un seau
- Appliqués via une lingette présaturée
Bien que ciblant les organismes nuisibles, les biocides sont des produits actifs susceptibles d’avoir des effets sur l’homme, l’animal ou l’environnement. Par conséquent, leur mise sur le marché est encadrée par la réglementation européenne, appelée Directive Biocide (BPR).
La mise en oeuvre réglementaire s’articule en deux étapes :
- Évaluation des substances actives biocides, aboutissant ou non à leur approbation
- Évaluation des produits qui les contiennent en vue de l’obtention d’une autorisation de mise sur le marché (AMM) uniquement dans le pays qui a délivré l’autorisation
Les étapes du bionettoyage
Le bionettoyage englobe un ensemble d’étapes et de procédés visant à éliminer les contaminants microbiens, chimiques et particulaires des surfaces et des équipements dans les zones de production pharmaceutique.
Dans les protocoles fondamentaux, pour éliminer tous les types de contaminants, 4 étapes sont nécessaires. Cependant, les évolutions de l’Annexe 1 des GMP EU rehaussent les niveaux d’exigence. Pour se mettre en conformité, nous recommandons de suivre 8 étapes :
- Dégrossissage : élimination des déchets de fabrication visibles pour faciliter le nettoyage ultérieur
- Dépoussiérage : décontamination particulaire et chimique par aspiration ou balayage humide
- Lavage/détergence : utilisation de détergents pour séparer la contamination de la surface
- Rinçage à l’eau PPI en cas d’utilisation de détergents pour éliminer les résidus
- Raclage : action mécanique pour éliminer les résidus
- Désinfection pour éliminer/réduire les micro-organismes
- Rinçage à l’eau PPI si désinfectant avec résidus (ammonium quaternaires)
- Raclage si rinçage pour éliminer les résidus de désinfectants
Piètement & Accessoires de la table de mirage CLEANVIEW®
Pour être en conformité avec l’Annexe 1 des GMP EU, toutes les étapes du processus de bionettoyage doivent être documentées, y compris les produits chimiques utilisés, les temps d’application et la méthode de contrôle.
En tant qu’industriel, vous avez une obligation de résultat : rester sous les seuils de contamination correspondant à la classe de propreté requise pour votre environnement de production.
En stérile, vous êtes tenu de valider que le bionettoyage a été efficace mais vous êtes libre d’établir le protocole qui vous permettra le mieux de répondre à cet objectif en tenant compte de vos usages et de vos contraintes de production. La fréquence de bionettoyage peut donc varier d’un industriel à l’autre.
De même, le choix des produits variera en fonction de critères liés au protocole que vous avez défini. Leur efficacité est validée par des normes européennes, ce qui a pour avantage de comparer aisément les biocides entre eux. Ces normes sont définies en fonction de l’usage et du secteur d’activité.
Les conditions d’application sont toutes aussi importantes et leur efficacité résulte de la combinaison de quatre facteurs (intervenant chacun pour 25 % dans l’efficacité d’une opération de décontamination) qui constituent le cercle de Sinner :
- La température, qui améliore la solubilisation des contaminations
- L’action mécanique : le fait de combiner différents outils, notamment le choix des tissus de nettoyage
- La chimie : le produit doit être choisi pour éliminer les contaminants, ne pas abîmer les surfaces et minimiser le risque de résidus
- Le temps de contact obligatoire entre micro-organismes et produits biocides pour les éliminer
En outre, la réglementation exige des industriels une analyse de risques qui implique une qualification des fournisseurs. Par conséquent, le choix d’un fournisseur reconnu pour vos produits biocides est préférable. De notre côté, nous travaillons en partenariat avec le fabricant Christeyns (gamme Klercide).
Le bionettoyage est une étape incontournable pour maintenir les requis de la salle propre et réduire les risques de contamination dans vos environnements de production.
Les évolutions de l’Annexe 1 des GMP EU nécessitent de relever le niveau d’exigence sur les opérations décontamination, avec l’ajout d’étapes supplémentaires dans le processus de bionettoyage.
Pour ce faire, STERIGENE vous accompagne à la fois dans la définition de vos protocoles de bionettoyage et dans le choix de produits tissus, biocides et accessoires de nettoyage, adaptés à votre activité, à vos usages et à vos contraintes.
Vous avez des interrogations sur les problématiques de bionettoyage ? Contactez-nous pour échanger avec un de nos experts.

